[비즈니스포스트] 셀트리온이 바이오시밀러(생체의약품 복제약) ‘램시마’를 더 편하게 투여할 수 있도록 개량한 제품을 미국에 선보인다.
셀트리온은 23일 미국 식품의약국(FDA)에 자가면역질환 치료제 ‘램시마SC’ 허가를 신청했다고 밝혔다.
![셀트리온, 미국에 바이오시밀러 '램시마' 피하주사제형 허가 신청]()
램시마SC는 기존 정맥주사(IV) 제형인 램시마를 피하주사로 개량한 약물로 앞서 유럽과 캐나다 등 40여 개 국가에서 판매 허가를 획득했다.
램시마SC는 정맥주사와 비교해 환자 편의성이 높다. 정맥주사로 의약품을 투여하기 위해서는 환자가 병원에 방문해 2~4시간을 들여야 한다. 반면 피하주사는 환자가 집에서 직접 몇 초만에 투여하는 게 가능해 통원 치료에 드는 시간과 비용을 아낄 수 있다.
셀트리온은 제형 편의성을 앞세운 램시마SC가 미국에서 허가를 획득하면 앞서 출시돼 판매되고 있는 램시마IV 제형과 시너지를 통해 시장점유율을 높일 수 있을 것으로 예상하고 있다.
셀트리온에 따르면 빠른 약효가 필요한 환자에게 램시마IV를 처방한 후 상태가 호전된 환자에게 램시마SC를 처방함으로써 약효를 유지하면서 치료효과를 극대화할 수 있다.
셀트리온 관계자는 “램시마SC는 앞서 진출한 유럽에서 빠른 투약 효과와 제형의 편의성을 앞세워 이미 12%가 넘는 시장점유율을 보이며 영향력을 확대하고 있다”며 “세계 최대 시장인 미국에서 램시마 제품군의 입지를 한층 강화하는 것은 물론 더 많은 환자에게 고품질의 의약품 치료 기회를 제공할 수 있을 것이다”고 말했다. 임한솔 기자
셀트리온은 23일 미국 식품의약국(FDA)에 자가면역질환 치료제 ‘램시마SC’ 허가를 신청했다고 밝혔다.
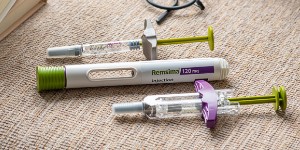
▲ 셀트리온은 23일 미국 FDA에 바이오시밀러 '램시마SC' 품목허가를 신청했다고 밝혔다. 램시마SC 제품 사진. <셀트리온>
램시마SC는 기존 정맥주사(IV) 제형인 램시마를 피하주사로 개량한 약물로 앞서 유럽과 캐나다 등 40여 개 국가에서 판매 허가를 획득했다.
램시마SC는 정맥주사와 비교해 환자 편의성이 높다. 정맥주사로 의약품을 투여하기 위해서는 환자가 병원에 방문해 2~4시간을 들여야 한다. 반면 피하주사는 환자가 집에서 직접 몇 초만에 투여하는 게 가능해 통원 치료에 드는 시간과 비용을 아낄 수 있다.
셀트리온은 제형 편의성을 앞세운 램시마SC가 미국에서 허가를 획득하면 앞서 출시돼 판매되고 있는 램시마IV 제형과 시너지를 통해 시장점유율을 높일 수 있을 것으로 예상하고 있다.
셀트리온에 따르면 빠른 약효가 필요한 환자에게 램시마IV를 처방한 후 상태가 호전된 환자에게 램시마SC를 처방함으로써 약효를 유지하면서 치료효과를 극대화할 수 있다.
셀트리온 관계자는 “램시마SC는 앞서 진출한 유럽에서 빠른 투약 효과와 제형의 편의성을 앞세워 이미 12%가 넘는 시장점유율을 보이며 영향력을 확대하고 있다”며 “세계 최대 시장인 미국에서 램시마 제품군의 입지를 한층 강화하는 것은 물론 더 많은 환자에게 고품질의 의약품 치료 기회를 제공할 수 있을 것이다”고 말했다. 임한솔 기자











