[비즈니스포스트] 대웅제약이 특발성 폐섬유증 치료제 베르시포로신의 상용화에 속도를 내고 있다.
대웅제약은 26일 열린 독립적 데이터 모니터링 위원회(IDMC) 회의에서 임상2상을 진행하고 있는 베르시포신의 안전성 데이터를 심층 검토한 결과 큰 문제점이 발견되지 않았다고 29일 밝혔다.
![대웅제약 특발성 폐섬유증 치료제 임상2상 순항, 이창재 "안전성 입증 이정표"]()
임상2상에서는 특발성 폐섬유증 환자 51명을 포함해 59명의 등록 환자를 대상으로 베르시포로신의 안전성을 점검했다.
IDMC는 내년 초 예정된 3차 회의에서 베르시포로신 임상2상의 안전성을 최종 점검하기로 했다. 임상2상을 2025년 안에 마치겠다는 계획도 세웠다.
특발성 폐섬유증(IPF)은 과도하게 생성된 섬유조직으로 인해 폐가 서서히 굳어지면서 폐 기능을 상실하는 폐 질환을 말한다. 치료가 쉽지 않아 진단 이후 5년 생존율이 40% 미만인 희귀 질환으로 알려져있다.
대웅제약에 따르면 현재 판매되는 특발성 폐섬유증 치료제는 질병 진행 자체를 완전히 멈추지 못하고 진행 속도를 늦추는 수준인 데다 이상 반응의 발생률이 높아 복용을 중도에 포기하는 사례가 많다.
베르시포로신은 콜라겐 합성을 직접적으로 억제하는 새로운 작용을 통해 기존 치료제와 차별화된 안전성과 효능을 보여줄 것으로 기대된다. 임상1상에서 건강한 사람을 대상으로 안전성과 약동학적 특성을 확인했다. 임상2상은 40세 이상의 특발성 폐섬유증 환자를 대상으로 현재 허가된 치료제를 복용 중이거나 중단한 환자들이 참여하고 있다.
임상시험은 24주 동안 베르시포로신 단독 및 기존 치료제와 병용 요법의 안전성, 내약성, 유효성을 평가한다.
임상 2상은 미국과 한국에서 2023년 1월부터 현재까지 61명의 환자를 모집해 목표 인원 102명의 약 60%를 달성했다. 국내 임상시험은 서울아산병원, 신촌세브란스병원, 서울삼성병원, 순천향대 부천병원, 부천성모병원, 아주대병원, 명지병원, 울산대병원, 인제대 부산백병원 등 10곳에서 진행되고 있다.
이창재 대웅제약 대표는 "이번 IDMC의 권고는 베르시포로신의 원활한 개발에 있어 안전성을 입증한 중요한 이정표"라며 "혁신 신약 후보 물질인 베르시포로신의 개발을 통해 특발성 폐섬유증 환자들에게 새로운 치료 옵션을 제공할 수 있도록 최선을 다하겠다"고 말했다. 장은파 기자
대웅제약은 26일 열린 독립적 데이터 모니터링 위원회(IDMC) 회의에서 임상2상을 진행하고 있는 베르시포신의 안전성 데이터를 심층 검토한 결과 큰 문제점이 발견되지 않았다고 29일 밝혔다.
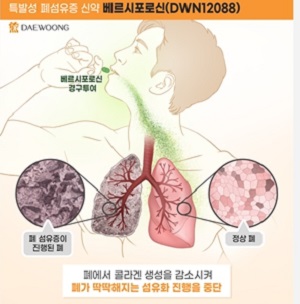
▲ 대웅제약이 29일 특발성 폐섬유증 치료제 베르시포로신의 임상2상 안전성 데이터를 검토한 결과 큰 문제점이 발견되지 않았다고 밝혔다. 사진은 베르시포로신 관련 이미지. <대웅제약>
임상2상에서는 특발성 폐섬유증 환자 51명을 포함해 59명의 등록 환자를 대상으로 베르시포로신의 안전성을 점검했다.
IDMC는 내년 초 예정된 3차 회의에서 베르시포로신 임상2상의 안전성을 최종 점검하기로 했다. 임상2상을 2025년 안에 마치겠다는 계획도 세웠다.
특발성 폐섬유증(IPF)은 과도하게 생성된 섬유조직으로 인해 폐가 서서히 굳어지면서 폐 기능을 상실하는 폐 질환을 말한다. 치료가 쉽지 않아 진단 이후 5년 생존율이 40% 미만인 희귀 질환으로 알려져있다.
대웅제약에 따르면 현재 판매되는 특발성 폐섬유증 치료제는 질병 진행 자체를 완전히 멈추지 못하고 진행 속도를 늦추는 수준인 데다 이상 반응의 발생률이 높아 복용을 중도에 포기하는 사례가 많다.
베르시포로신은 콜라겐 합성을 직접적으로 억제하는 새로운 작용을 통해 기존 치료제와 차별화된 안전성과 효능을 보여줄 것으로 기대된다. 임상1상에서 건강한 사람을 대상으로 안전성과 약동학적 특성을 확인했다. 임상2상은 40세 이상의 특발성 폐섬유증 환자를 대상으로 현재 허가된 치료제를 복용 중이거나 중단한 환자들이 참여하고 있다.
임상시험은 24주 동안 베르시포로신 단독 및 기존 치료제와 병용 요법의 안전성, 내약성, 유효성을 평가한다.
임상 2상은 미국과 한국에서 2023년 1월부터 현재까지 61명의 환자를 모집해 목표 인원 102명의 약 60%를 달성했다. 국내 임상시험은 서울아산병원, 신촌세브란스병원, 서울삼성병원, 순천향대 부천병원, 부천성모병원, 아주대병원, 명지병원, 울산대병원, 인제대 부산백병원 등 10곳에서 진행되고 있다.
이창재 대웅제약 대표는 "이번 IDMC의 권고는 베르시포로신의 원활한 개발에 있어 안전성을 입증한 중요한 이정표"라며 "혁신 신약 후보 물질인 베르시포로신의 개발을 통해 특발성 폐섬유증 환자들에게 새로운 치료 옵션을 제공할 수 있도록 최선을 다하겠다"고 말했다. 장은파 기자









![[6일 오!정말] 국힘 권영진](https://businesspost.co.kr/news/photo/202602/20260206163923_176657.png)

