▲ 2022년 세포유전자치료제 기업 현황. <한국바이오협회>
한국바이오협회는 7일 ‘2023년 글로벌 세포․유전자치료제 시장 동향’ 보고서를 통해 “2022년 미국과 유럽에서 세포유전자치료제 6개가 최초로 허가됐다”며 “1월 현재 세포유전자치료제에 대한 임상이 2220개 진행되고 있다”고 밝혔다.
지난해 새로 허가된 치료제를 보면 얀센의 다발골수종 치료제 ‘카빅티’는 미국과 유럽에서 모두 승인됐다. 바이오마린의 혈우병 치료제 ‘록타비안’, PTC테라퓨틱스의 희귀 신경질환 치료제 ‘업스타자’, 아타라바이오테라퓨틱스의 이식 후 림푸구증식질환(PTLD) 치료제 ‘에브발로’는 유럽 허가를 받았다. 페링파마슈티컬스의 방광암 치료제 ‘애즈틸라드린’, CSL베링의 혈우병 치료제 ‘헴제닉스’는 미국에서 허가를 획득했다.
이 밖에 기존 세포유전자치료제 5종이 새로운 지역에 출시되거나 적응증을 확대한 것으로 파악됐다.
세포유전자치료제 전체 임상 2220개는 지역별로 북미 43%, 아시아태평양(APAC) 38%, 유럽 18% 등으로 나뉜다. 지난해 새로 추가된 임상은 254개로 이 가운데 48%는 아시아태평양 지역에서 추가됐다.
진행 중인 임상의 60%는 종양 치료를 목적으로 하며 고형암과 혈액암의 비중이 비슷한 것으로 분석됐다.
2022년 세계 세포유전자치료제 투자 규모 126억 달러로 전년 227억 달러보다 44%가량 줄었다. 이전까지 세포유전자치료제 투자는 2019년 98억 달러, 2020년 199억 달러, 2021년 227억 달러 등으로 증가세를 보여 왔다.
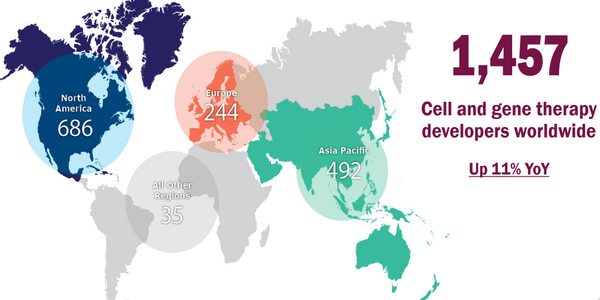
투자 규모는 감소했으나 세계 세포유전자치료제 개발기업은 전년보다 11% 증가해 1457개에 이르렀다. 기업들은 북미 686개, 아시아태평양 492개, 유럽 244개, 기타 35개 등으로 분포한다.
한국바이오협회는 올해 미국에서 세포유전자치료제 개발이 활발할 것으로 내다봤다. 올해 세포․유전자치료제 최대 14개의 허가 여부가 결정되고 이 가운데 최소 5개 이상이 허가를 받을 것으로 예상했다.
반면 유럽의 개발은 정체될 것으로 전망했다.
한국바이오협회는 “유럽에서는 첨단바이오의약품(ATMP)으로 허가받은 치료제 24개 중 7개가 보험 급여 등의 쟁점으로 인해 철수됐고 2022년 임상1상에 단지 3개만이 신규로 진입했다”며 “이는 유럽에서 세포유전자치료제가 여전히 유전자변형생물체(GMO) 규제를 받고 있는 등의 문제를 가지고 있기 때문으로 알려졌다”고 말했다.
이번 보고서 내용은 미국 재생의료연합의 티모시 헌트 대표가 올해 1월 JP모건 헬스케어 콘퍼런스에서 발표한 내용을 정리한 것이다. 임한솔 기자








![[여론조사꽃] 민주당 조국혁신당 합당, 양당 지지층 70%안팎 '찬성'](https://businesspost.co.kr/news/photo/202602/20260209104958_80899.png)


