렘데시비르가 코로나19 환자 치료제로서 미국 식품의약국(FDA)의 정식사용 승인을 받은 첫번째 의약품이 됐다.
23일 CNBC와 로이터 등에 따르면 미국식품의약국은 22일 항바이러스제인 렘데시비르를 코로나19 입원환자 치료에 쓸 수 있도록 정식 허가를 내줬다.
![미국 식품의약국, 코로나19 치료제로 렘데시비르 정식사용 허가]()
렘데시비르를 개발한 미국 제약사 길리어드사이언스의 대니얼 오데이 길리어드 최고경영자는 "코로나19 대유행 시작부터 길리어드는 글로벌 보건위기의 해법을 찾기 위해 노력했다"며 "1년도 안 돼 미국에서 이 약을 필요로 하는 모든 환자에게 사용 가능하다는 식품의약국 승인을 얻게 된 것이 믿기지 않는다"고 말했다.
렘데시비르는 원래 에볼라 치료제로 개발된 정맥주사 형태의 약이지만 코로나19 입원 환자들을 대상으로 한 임상시험에서 회복기간이 5일 단축되는 등 효과를 보인 것으로 알려졌다.
렘데시비르는 코로나19에 감염됐던 도널드 트럼프 미국 대통령에게 투여되기도 했다.
다만 세계보건기구(WHO) 연구 결과에서는 렘데시비르가 환자의 입원기간을 줄이거나 사망률을 낮추지 못한 것으로 나타났다.
경증 환자에 대해서는 별다른 효험이 없다는 지적도 나오고 있다.
길리어드는 8월 2020년 말까지 200만 명 투여분 이상을 생산하고 2021년에는 수백만 회분을 더 만들겠다는 계획을 내놨다. [비즈니스포스트 안정문 기자]
23일 CNBC와 로이터 등에 따르면 미국식품의약국은 22일 항바이러스제인 렘데시비르를 코로나19 입원환자 치료에 쓸 수 있도록 정식 허가를 내줬다.
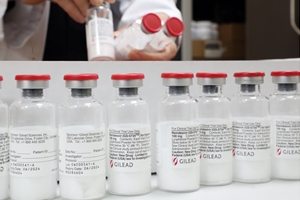
▲ 렘데시비르.
렘데시비르를 개발한 미국 제약사 길리어드사이언스의 대니얼 오데이 길리어드 최고경영자는 "코로나19 대유행 시작부터 길리어드는 글로벌 보건위기의 해법을 찾기 위해 노력했다"며 "1년도 안 돼 미국에서 이 약을 필요로 하는 모든 환자에게 사용 가능하다는 식품의약국 승인을 얻게 된 것이 믿기지 않는다"고 말했다.
렘데시비르는 원래 에볼라 치료제로 개발된 정맥주사 형태의 약이지만 코로나19 입원 환자들을 대상으로 한 임상시험에서 회복기간이 5일 단축되는 등 효과를 보인 것으로 알려졌다.
렘데시비르는 코로나19에 감염됐던 도널드 트럼프 미국 대통령에게 투여되기도 했다.
다만 세계보건기구(WHO) 연구 결과에서는 렘데시비르가 환자의 입원기간을 줄이거나 사망률을 낮추지 못한 것으로 나타났다.
경증 환자에 대해서는 별다른 효험이 없다는 지적도 나오고 있다.
길리어드는 8월 2020년 말까지 200만 명 투여분 이상을 생산하고 2021년에는 수백만 회분을 더 만들겠다는 계획을 내놨다. [비즈니스포스트 안정문 기자]






![[조원씨앤아이] 서울시장 양자대결, 정원오 47.5% vs 오세훈 33.3%](https://businesspost.co.kr/news/photo/202601/20260127153647_266497.png)
![[단독] 네이버 사우디에서 '루키2'로 로봇배송 상용화 실험, 최수연 한국 도시 적용 완성도 높인다](https://businesspost.co.kr/news/photo/202602/20260211160952_174018.jpg)
![[코스피 5천 그늘③] CJ그룹 식품·물류·콘텐츠 투자매력 희미, 이재현 주가 부양 카드 언제 꺼내나](https://businesspost.co.kr/news/photo/202508/20250827144344_200101.jpg)


